Три случая
гидролиза солей
Чтобы написать реакцию гидролиза
соли, необходимо предварительно
провести анализ соли.
Первый случай гидролиза
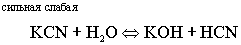
Помимо растворения соли происходит
ее гидролиз. Гидролиз всегда протекает по
слабой составляющей.
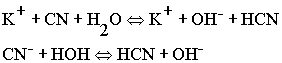
PH >7
- щелочная
среда.
Соль, образованная сильным гидроксидом
и слабой кислотой, гидролизуется по аниону, в результате образуется
слабо диссоциирующая кислота, а в растворе накапливаются гидроксид
- ионы, создавая щелочную среду.
Рассмотрим, по какой причине гидролиз протекает незначительно, но
с большим сдвигом в обратную сторону.
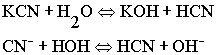
Гидролиз соли протекает до тех
пор, пока происходит диссоциация воды. Диссоциация воды, в свою
очередь, происходит до тех пор, пока не начнётся диссоциация слабого
элемента.

Пока ионы Н2 связываются в слабую кислоту, происходит
диссоциация воды.
H2O  H+ + OH-
H+ + OH-
В соответствии со своей степенью диссоциации начинает диссоциировать
слабая кислота. В реакцию вступают ионы водорода, и диссоциация
воды прекращается.
Таким образом, гидролиз соли прекращается
тогда, когда начинается диссоциация слабого электролита.
Вывод. Чем слабее составляющая соли, тем полнее
протекает гидролиз.
Второй случай гидролиза
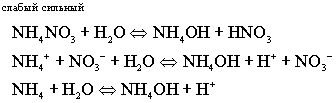
PH < 7
- кислая среда
Соль, образованная слабым гидроксидом
и сильной кислотой, гидролизуется по катиону, образуя слабый гидроксид.
В ходе реакции накапливаются ионы
водорода, создавая кислую среду.
Третий случай
гидролиза
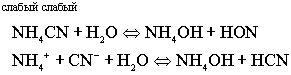
PH = 7
- характер среды слабо щелочной,
слабокислый, нейтральный.
Соль образованная слабым гидроксидом и сильной кислотой, гидролизуется
одновременно по катиону и аниону. Очевидно, что гидролиз протекает
глубже, чем в первых двух случаях. Характер среды слабо щелочной,
слабокислый, нейтральный.
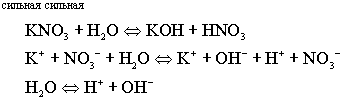
Соль, образованная сильным гидроксидом и сильной кислотой, не гидролизуется.
Нет взаимодействия ионов соли с водой, следовательно нет гидролиза.
Процесс сводится к диссоциации воды.
Если соль образована
слабым гидроксидом и слабой кислотой, то реакция раствора зависит
от относительной силы образующихся в результате гидролиза кислоты
и основания.