Основными
оксидами называют те, которые с водой образуют
гидроксиды (образованы металлами)
Li2O + H2O = 2LiOH.
Кислотными оксидами
называют оксиды, которые при взаимодействии с водой образуют кислоты
или соответствуют кислотам.
N2O5 + H2O = 2HNO3
Кислотные оксиды образуются неметаллами.
Амфотерные оксиды
образуются амфотерными металлами.
Амфотерными называются оксиды, которые образуют и кислоты, и гидроксиды
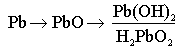 .
.
Несолеобразующими оксидами
называются оксиды, которые не образуют и не соответствуют ни кислотам,
ни гидроксидам:
СО, N2O,
NO.
2.
Гидроксиды
Гидроксиды
– электролиты, которые в воде диссоциируют на ионы металлов и
гидроксид - ионы.
NaOH = Na+ + OH-
Ca (OH)2 = Ca2++ 2OH-

Именно гидроксид - ионы обусловливают общие свойства класса гидроксидов,
включая окраску индикаторов.
Гидроксиды подразделяются на хорошо и плохо растворимые в воде.
Хорошо растворимые
в воде гидроксиды называются щелочами.
Щёлочи образуются
металлами, располагающимися в главных подгруппах первой и второй
групп таблицы Менделеева кроме магния и вериллия.
Щёлочи являются
сильными электролитами, диссоциирующими в водных растворах необратимо.
Все остальные гидроксиды являются трудно растворимыми в воде соединениями
и слабыми электролитами.
Существуют два
исключения: