Комплексные, или
координационные, соединения относятся к многочисленному классу соединений,
в состав которых могут входить как неорганические, так и органические
соединения в виде нейтральных или заряженных частиц. По своей многочисленности
они занимают второе место после органических соединений.
CuSO4+2NaOH=
 Cu(OH)2+Na2SO4
Cu(OH)2+Na2SO4
Cu(OH)2 + 4NO3
+ 4NO3 |
= Cu(OH)2*
4NH3 |
| (голубой осадок) |
(раствор василькового цвета)
|
Такие соединения называются соединениями
высшего порядка, или комплексными.
Современная координационная химия связана с именем швейцарского
химика А. Вернера,
сформулировавшего основные положения координационной теории (1893
г.).
По этой теории центром комплексного соединения является ион метала,
как правило, d – элемента, реже p – элемента.
Центральный ион (атом) комплексного
соединения называется комплексообразователем.
Координационными
называют соединения, содержащие в одном из агрегатных состояний
группу ионов или нейтральных молекул (лигандов), в определенном порядке размещенных (координированных)
вокруг атома (иона) – комплексообразователя) .
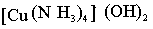
Лигандами могу быть нейтральные
молекулы (NH3, H2O, CO), кроме того, лигандами
являются различные анионы, различные кислотные остатки (OH-,
Ce-, NO2-).
Число, стоящее за круглыми скобками,
называется координационным числом.
Координационное число показывает, какое количество лигандов координирует
вокруг себя данный комплексообразователь. Таким образом, комплексообразователь
имеет две характеристики:
-
заряд,
-
координационное
число.
Комплексообразователь |
Заряд |
Координационное
число |
H |
1 |
2 |
Cu |
2 |
4 |
Bi |
3 |
4 |
Комплексообразователь с лигандами
образуют (внутреннюю сферу комплексного соединения), или комплексный
ион.
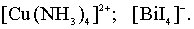
Заряд комплексного иона представляет собой алгебраическую сумму
зарядов комплексообразователя и лигандов.
Система
названий комплексных соединений
Название комплексного соединения
зависит от того, катионом или анионом является внутренняя сфера.
Число лигандов каждого вида обозначается
греческими числительными: