Запишем реакцию без коэффициентов:
К2Сr 2O7 +H 2SO4
+ FeSO4 K2SO4 + Cr2(SO4)3
+Fe2SO4)3 + Н2О
K2SO4 + Cr2(SO4)3
+Fe2SO4)3 + Н2О
K2Cr2O7
и FeSO4 – реагирующие вещества;
Н2SO4
– среда, в которой протекает реакция.
Составим краткую ионную реакцию:
Cr2O72-
+ 2H+ + Fe2+  2Cr3+ + 2Fe3+ + H2O
2Cr3+ + 2Fe3+ + H2O
Разобьем ОВР на полуреакции
окисления и восстановления:
| Cr2O72- |
 2Cr3+
2Cr3+ |
| Fe2+ |
 2Fe3+
2Fe3+ |
В полуреакциях уравняем частицы,
учитывая кислый характер раствора:
| Cr2O72-
+ 14H+ |
 2Cr3+ + 7H2O
2Cr3+ + 7H2O |
| 2Fe2+ |
 2Fe3+
2Fe3+ |
В полуреакциях уравняем заряды,
определяя число электронов, отдаваемых восстановителем Fe2+
и принимаемых окислителем Cr2O72-:
Cr2O72-
+ 14H+ + 6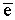 |
= 2Cr3+ + 7H2O
|
2Fe2+ - 2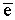 |
= 2Fe3+ |
Уравняем в полуреакциях число
принимаемых и отдаваемых электронов:
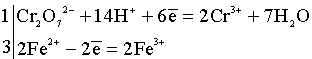
Суммируем полуреакции в общую
окислительно-восстановительную реакцию:
Cr2O72-
+ 14H+ + 6Fe2+ = 2Cr3+ + 6Fe3+
+7H2O
Полученные коэффициенты перенесём
в молекулярную реакцию:
К2Cr2O7
+ 7H2SO4 + 2FeSO4 =
= K2SO4+
Cr2(SO4)3 +3Fe2(SO4)3
+ 7Н2О
Проверим баланс кислорода в
левой и правой части уравнения.
Если число атомов кислорода
в обеих частях уравнения одинаково, данное уравнение составлено
верно.