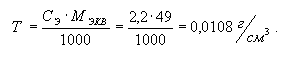Концентрация
растворов
Раствором называется твердая или
жидкая гомогенная (однородная) система, состоящая из двух или более
компонентов.
Необходимыми компонентами раствора
являются растворитель и растворенное вещество, например, растворенный
в воде сахар.
В одном растворителе может находиться
несколько растворенных веществ. Например, в воде растворены сахар,
соль и уксусная кислота.
Количество растворенного вещества
в определенном количестве раствора или растворителя, которое может
колебаться в очень широких пределах, называется концентрацией раствора.
Существует несколько способов выражения
концентрации растворов.
1. Массовая
концентрация (Р)
– это растворенное вещество, выраженное в граммах, содержащееся
в 100 граммах раствора:
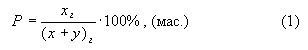
где
хг – масса растворенного вещества;
уг – масса растворителя;
(х + у)г – масса раствора.
Масса раствора может быть выражена
произведением плотности раствора на его объем:
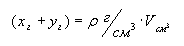
отсюда
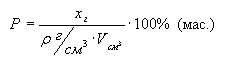 .
.
Например, 5%-ный раствор означает:
2. Молярная
концентрация (СВ) – это количество моль растворенного
вещества, в 1дм3 раствора:
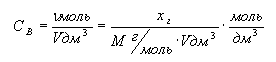 .
.
Например, запись: 0,2М НСl означает,
что 0,2 моль НСl растворено в 1 дм3 раствора.
3. Эквивалентная
(нормальная) концентрация (СЭ или СН)
– это количество моль эквивалента растворенного вещества в 1 дм3
раствора:
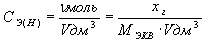
Например, запись: 0,5Н Н2SO4
означает, что 0,5 моль эквивалента серной кислоты содержится в 1дм3
раствора.
Под эквивалентом
элемента понимают также его количество, которое соединяется с одним
молем атомов водорода или замещает то же количество атомов водорода
в химических реакциях.
Например, в соединениях НСl, H2S,
NH3 эквивалент хлора, серы и азота равен соответственно
1 моль, 1/2 моль, 1/3 моль.
Молярная масса эквивалента кислоты
– это частное деление молярной массы кислоты на количество ионов
водорода, участвующих в реакции:
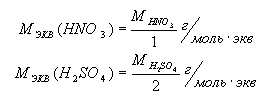 .
.
Молярная масса эквивалента гидроксида
– это частное деление молярной массы гидроксида на количество гидроксид-ионов,
участвующих в реакции:
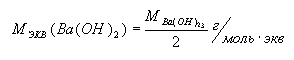 .
.
Молярная масса эквивалента соли
– это частное деление молярной массы соли на произведение валентности
металла соли на количество его частиц в формуле соли:
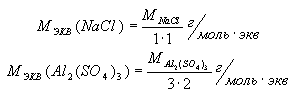 .
.
4. Моляльная
концентрация
(СM) – это количество моль растворенного
вещества в кг растворителя.
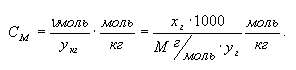 .
.
5. Титр
раствора (T)
– это растворенное вещество, выраженное в граммах, в 1см3
раствора:
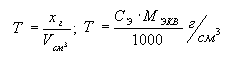 .
.
Закон
эквивалентов
Если два раствора взаимодействуют
между собой в эквивалентных количествах, то зная концентрацию одного
из растворов и прореагировавшие объемы обоих растворов, можно рассчитать
неизвестную концентрацию второго раствора по соотношению:
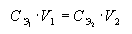 .
.
Пример
решения задачи
Дан раствор серной кислоты концентрацией
10%. Плотность данного раствора равна 1,075г/см3.
Рассчитать моляльную, молярную,
эквивалентную концентрацию раствора и его титр.
Решение. Рассчитаем
моляльную концентрацию:
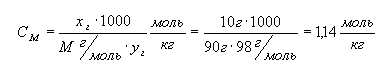 .
.
Рассчитаем молярную
концентрацию. Для этого произвольно выберем
объем раствора.
Пусть V = 1 дм3, тогда:
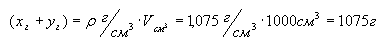 .
.
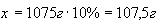 .
.
Отсюда
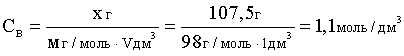 .
.
Рассчитаем эквивалентную
концентрацию:
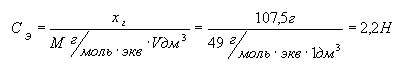 .
.
Рассчитаем титр
раствора: