Кипение
и замерзание растворов
( Второй закон Рауля )
Второй закон Рауля определяет изменение температуры кипения и
замерзания растворов по сравнению с чистыми растворителями.
Данный растворитель
закипает при той температуре, при которой давление его насыщенного
пара достигает атмосферного
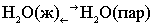 .
.
Раствор закипает при более высокой температуре, так как концентрация
молекул растворителя в нём всегда ниже, чем в чистом растворителе,
и давление насыщенного пара раствора достигает атмосферного при
более высокой температуре.
Температура замерзания (кристализации) раствора ниже температуры
замерзания чистого растворителя. Это обусловлено более низким
давлением пара растворителя над раствором, чем над растворителем.
Второй закон Рауля определяет, чему равно изменение температуры
кипения и замерзания растворов.
Изменение температуры кипения и замерзания растворов пропорционально
моляльной концентрации растворов
Δt0кипения = Кэ См,
Δt0замерзания
= Кк См.
Рассмотрим коэффициенты пропорциональности :
Кэ
– эбуллиоскопическая константа,
Кк – криоскопическая константа.
Каждый растворитель имеет свои значения Кэ и Кк
.
Эбулеоскопические
и криоскопические константы некоторых растворителей приведены в табл.1.
Таблица
1
Растворитель |
Кэ |
Кк |
H2O |
0,53 0c |
1,86 0c |
C6H6 |
2,57 0c |
5,02 0c |
Вывод: изменение
температуры кипения и замерзания растворов зависит от природы растворителя
концентрации раствора.
Физический смысл этих констант заключается в том, что при концентрации
раствора, равной 1 моль/кг, данные константы равны изменению температуры
кипения или замерзания данного раствора.
В отличие от чистых растворителей, которые кипят и замерзают при
постоянной температуре, растворы кипят и замерзают в некотором интервале
температур.
Закон
Вант - Гоффа
Закон Вант – Гоффа определяет величину осмотического давления раствора.
Чтобы ознакомиться с понятием осмоса,
рассмотрим сосуд, разделённый на две части полупроницаемой мембраной.
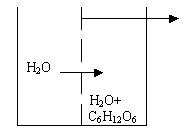 |
Полупроницаемая
мембрана – перегородка, через которую проникают молекулы растворителя,
но не проходят частицы растворённого вещества. |
Осмос представляет
собой самопроизвольное одностороннее перемещение молекул растворителя
через полупроницаемую мембрану из той части системы, где концентрация
растворителя выше, в ту часть системы, где его концентрация ниже.
Определение осмотического давления растворов производится следующим
образом. Во внешний сосуд наливается
чистая вода, стенки внутреннего сосуда представляют собой полупроницаемую
мембрану. Внутренний сосуд снабжен оттянутой горловиной и мерительной
линейкой. Во внутреннем сосуде находится какой - либо раствор, например,
сахара.
В силу осмоса молекулы воды из внешнего сосуда через полупроницаемые
стенки будут проходить во внутренний, движение молекул в этом приборе
только одностороннее.
Таким образом,
объём раствора во внутреннем сосуде увеличивается и поднимается
по оттянутой горловине. В результате разницы в уровнях жидкостей
во внешнем и внутреннем сосудах в приборе возникает гидростатическое
давление. Это давление препятствует осмосу.
Величина гидростатического давления, при которой осмос прекращается,
называется осмотическим давлением раствора. (Росмотическое,
кПа )
Росмотическое
= RTCB кПа, где
R – универсальная газовая постоянная 8,31 Дж/моль,
T – абсолютная температура, K,
CB – молярная концентрация раствора