Условия
необратимого протекания реакций между электролитами
Все электролиты
диссоциируют на ионы, поэтому суть реакции между электролитами
выражают кратким ионным уравнением.
Для того, чтобы
реакция между электролитами протекла необратимо, необходимо,
чтобы часть ионов оказалась связанной или в легко летучее соединение,
или в трудно растворимый осадок, или в слабый электролит.
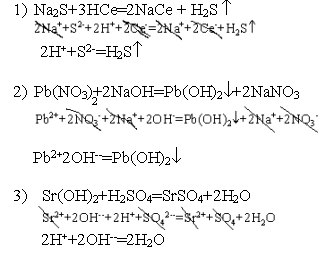
Условия
выпадения осадков труднорастворимых электролитов. Произведение
растворимости
 |
|
Поскольку абсолютно
нерастворимых веществ нет, какая - то часть AgCl перейдёт
в раствор. Поскольку AgCl - сильный электролит, все молекулы,
перешедшие в раствор, диссоциируют на ионы, и в растворе
будут находится ионы. |
Любой раствор может быть насыщенным,
ненасыщенным и перенасыщенным.
Ненасыщенным
называют раствор, в котором при данной температуре можно растворить
ещё какое - то количество данного вещества.
Насыщенным
называют раствор, в котором скорость реакции растворения равна
скорости реакции осаждения.
Концентрация насыщенного раствора
для данного вещества при данной температуре есть величина постоянная,
следовательно в насыщенном растворе концентрации ионов данного
электролита являются константами.
Перенасыщенными
называют растворы, которые содержат осадок.
Насыщенные растворы трудно
растворимых электролитов характеризуется величиной, называемой
произведением растворимости.
AB - трудно растворимый электролит
AB=A++B-
ПРАВ = [A+]*[B-] - насыщенный
раствор,
ПРАВ > [A+]*[B-] - ненасыщенный
раствор,
ПРАВ < [Ag+]*[B-] - перенасыщенный
раствор.
Be(OH)3  Bi3++3OH-
Bi3++3OH-
ПРBi(OH)3 =
[Bi3+]*[OH--]3.
Добавление в раствор одноимённых ионов труднорастворимого электролита
способствует выпадению в осадок иона противоположного знака
PbSO4 = Pb2+ + SO42-
ПРPbSO4 = [Pb2+]*[
SO42-] = 2,2*10-1
Na2SO4
= 2Na+ + SO42-
[Pb2+] 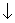 .
.