Область перекрытия
показывает место нахождения общей электронной пары и называется
областью повышенной электрической
плотности.
3. Полярность
Ковалентные
частицы могут быть полярными и неполярными. Полярная ковалентная
связь возникает в том случае, если частица образованна атомами
с различными электроотрицательностями.
| |
+1
-1 |
| HF |
|
| ЭО (Н) = 2,1 |
+1
-1 |
| ЭО (F) = 4 |
H :
F |
В молекуле возникают два поля – диполи (+ ; -), между которыми
есть какое-то расстояние. Диполь определяется дипольным моментом,
который равен заряду электрона, умноженному на дипольное расстояние
μ
= е • l
Размерность
дипольного момента Кулон/метр (Кл/м).
Чем больше разница между электроотрицательностью элементов,
тем больше дипольный момент сложной частицы, т.е. тем полярней
диполь.
Неполярная ковалентная
связь возникает в том случае, если частица образуется атомами
с одинаковой электроотрицательностью.
В ковалентных неполярных частицах общая электронная пара принадлежит
одинаково ядрам обоих атомов.
 расстояние между "+" и "–" равно нулю.
расстояние между "+" и "–" равно нулю.
Дипольный момент
тоже равен нулю.
Полярность связи
и полярность частиц не всегда совпадают между собой.
Полярность – векторная величина. Вектор всегда направлен от
менее электроотрицательных элементов к более электроотрицательным
элементам.
В молекуле СО2 два вектора, равные по величине,
но противоположные по направлению, компенсируют друг друга,
и молекула оказывается неполярной при полярной связи.
4.
Насыщаемость
ковалентной связи заключается в том, что все неспаренные валентные
электроны обязаны участвовать в образовании сложных частиц.
Электроны обладают способностью самопроизвольно перераспределяться
по подуровням в пределах одного энергетического уровня (без
изменения главного квантового числа).
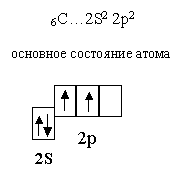
Из четырёх валентных электронов неспаренными являются два и
 валентность
углерода в данном случае равна двум.
валентность
углерода в данном случае равна двум.

Теперь все четыре валентных электрона распарены,  и валентность углерода равна четырем.
и валентность углерода равна четырем.