ПРАКТИЧЕСКАЯ
РАБОТА N 3
ПРИРОДНЫЕ
ВОДЫ
Природные
воды –
все воды земного шара как планеты. В природных условиях вода не встречается
в химически чистом виде. Она представляет собой раствор, часто сложного
состава, который включает газы (O2 , CO2
, H2S, CH4 и
др.), органические и минеральные вещества. В природных водах обнаружено
подавляющее большинство химических элементов. Наиболее распространенные
ионы: Na+ , Ca2+
, Mg2+ , Fe2+
, Fe3+ , Cl-
, SO42- , HCO3-
, NO3- , а также
кремниевая кислота H2SiO3.
Описание
природной воды по формуле М.Г. Курлова
Для
удобства сопоставления анализов воды существуют различные способы сокращённого
изображения состава. Наиболее часто применяется формула М.Г. Курлова
– это наглядное изображение химического состава природной воды.
В этой формуле, выражаемой в виде псевдодроби, в числителе пишут в процент-эквивалентах
в убывающем порядке анионы, а в знаменателе в таком же порядке катионы.
Ионы, присутствующие в количестве менее 10 % экв, в формулу не вносят.
К символу иона приписывают его содержание в процент-эквивалентах в целых
числах. Впереди дроби указывают величину минерализации (М) в г/л, pH,
жёсткость в мг·экв /л и компоненты, специфичные для данного анализа
(CO2, H2S, Br-,
J-, радиоактивность и др.). После дроби
указывают температуру воды (t0 C) и дебит
источника или скважины в (D), м3 / сут.
Например:

А
теперь последовательно рассмотрим составные части формулы М.Г. Курлова.
Водородный
показатель – pH
В воде часть молекул всегда находится в диссoциированном состоянии в
виде ионов H+ и OH-.
Концентрация недиссоциированной воды считается постоянной, поэтому количество
ионов водорода и ионов гидроксила при данной температуре будет тоже
величиной постоянной. При t 220 С эта величина равна 10-14.
Чистая вода имеет нейтральную реакцию и количество ионов H+
должно быть равно количеству ионов OH-.
[H+] = [OH-]
= 10-7
Это выражение показывает, что при 220 С в 1 л чистой воды
содержится 10-7 грамм-молекул воды в ионизированном виде,
т.е. 10-7 грамм-ионов водорода и 10-7 грамм-ионов
гидроксила.
Если
[H+] = 10-7, то lg [H+] = -7,
а – lg [H+] = 7
Выражение – lg [H+] означает pH – отрицательный
десятичный логарифм концентрации водородных ионов.
Если pH < 7 – реакция воды кислая;
Если pH > 7 - реакция воды щелочная;
pH < 4,5 – сильнокислая;
4,5 – 5,5 – кислая;
5,5 – 6,5 – слабокислая;
6,5 – 7,5 – близкая к нейтральной;
7,5 – 8,5 – слабощелочная;
8,5 – 9,5 – щелочная;
> 9,5 – сильнощелочная.
Жёсткость
воды
Жёсткостью воды называется свойство воды, обусловленное содержанием
в ней ионов кальция (1/2 Ca2+) и магния
(1/2 Mg2+). Единицей жёсткости воды является
моль на кубический метр (моль/м3). Числовое
значение жёсткости, выраженное в моль /м3
равно числовому значению жёсткости, выраженному в мг·экв
/л. 1 мг/л жёсткости воды отвечает содержанию ионов кальция (1/2 Ca2+)
20,04 мг/л и ионов магния (1/2 Mg2+) 12,153
мг/л.
Виды
жёсткости воды
Различают жёсткость воды общую
- общее количество содержащихся в воде ионов кальция и магния; устранимую
– жёсткость воды, обусловленная наличием в воде карбонатных (CO32-)
и гидрокарбонатных (HCO3-)
ионов солей кальция и магния, удаляемая при кипячении и определяемая
экспериментально; неустранимую
- разность между общей жесткостью и устранимой жесткостью; карбонатную
– сумма карбонатных (CO32-)
и гидрокарбонатных (HCO3-
) ионов в воде; некарбонатную
- разность между общей жёсткостью и карбонатной.
По величине общей жёсткости (по А.О. Алекину) различают следующие природные
воды:
очень мягкие до 1,5 мг·экв /л
мягкие 1,5 – 3 мг·экв /л
умеренно-жёсткие 3 – 6 мг·экв /л
жёсткие 6 – 9 мг·экв /л
очень жёсткие > 9 мг·экв /л
Минерализация
воды.
Минерализация (М) воды - концентрация растворённых в воде твёрдых
неорганических веществ. Различают характер и степень минерализации.
Характер
минерализации
обусловлен химическим типом воды. По О.А. Алекину воды делятся на
три класса по преобладающему аниону - гидрокарбонатные, сульфатные,
хлоридные. Каждый класс подразделяется на три группы по преобладающему
катиону - Na+, Ca2+,
Mg2+.
Степень
минерализации.
Степень минерализации выражают в мг/л или г/л (иногда г/кг) и определяют:
1). По
сухому остатку, который получают путём выпаривания природной воды.
Если количество воды выражено в мл, концентрацию солей в воде называют
минерализацией
- М (г/л, мг/л). Если количество воды взято в г, то концентрацию солей
в воде называют с о л ё н о с т ь ю - S (г/кг, % 0).
2). По
химическому составу природной воды. Определяют как арифметическую
сумму весовых количеств всех ионов в 1 л воды:

По степени
минерализации (по В.И. Вернадскому, 1931-36 гг.; И.К. Зайцеву, 1958
г.) природные воды подразделяются на:
пресные
до 1 г/л;
солоноватые 1 - 10 г/л;
солёные 10 - 50 г/л;
рассолы > 50 г/л
Псевдодробь:
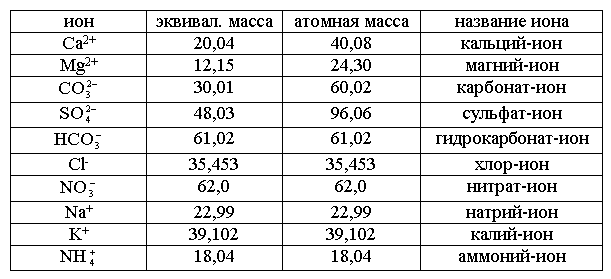
1. Из лаборатории получаем результаты химических анализов воды в мг/л.
2.
Полученные исходные данные пересчитываем в мг·экв
путём деления результатов анализа в мг/л на э к в и в а л е н т н у
ю массу соответствующего иона (табл. 1).
Например: концентрация Ca2+ 79 мг/л (результат
химического анализа (табл. 2), чтобы получить эквивалентную массу кальция,
нужно его атомную массу 40,08 разделить на валентность, т.е. 2, получим
эквивалентную массу 20,04, затем 79:20,04 = 3,95 мг·экв/л.
Пересчитать
в мг·экв форму можно другим способом. Для этого
исходные данные в мг/л умножить на соответствующие пересчётные коэффициенты.
Величину пересчётного коэффициента получим путём деления е д и н и ц
ы на эквивалентную массу.
Пересчётный
коэффициент для кальция: 1:20,04 = 0,0499. Для одновалентных ионов эквивалентной
массой будет атомная масса.
Таблица
1
3.
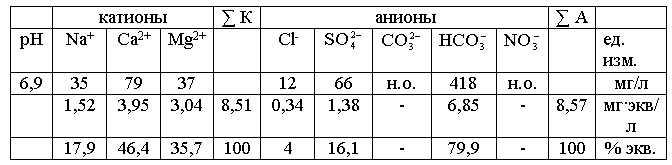
Для вычисления процент – эквивалентов (% · экв.)
принимаем сумму мг · экв. анионов (ΣА),
содержащихся в 1 л воды за 100 % и вычисляем процент содержания каждого
аниона в мг?экв по отношению к этой сумме. Аналогично вычисляем % экв.
катионов.
Например: (табл. 2) сумма катионов равна 8,51
8,51 – 100 %
1,52 – х
х = 17,9 % · экв. (Na)
Суммы катионов и анионов, выраженные в мг·экв
/л, должны быть равны между собой. Часто точного совпадения цифр в виду
погрешностей анализа не бывает. Допустимая неточность анализа (х) определяется
по формуле:

Σ А – сумма мг·экв /л анионов;
Σ К – сумма мг·экв /л катионов.
Образец
выполнения задания:
В таблицу 2 записываем результаты химических анализов воды, выраженные
в 3х формах:
1) мг/л; 2) мг·экв /л; 3) % экв.
Таблица
2
ж = 3,95
+ 3,04 = 6,99

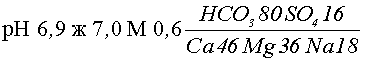
Вода,
близкая к нейтральной, жёсткая, пресная, гидрокарбонатно-магниево-кальциевая.
В название химического состава воды входят ионы, содержание которых
≥ 25 % экв. и называют воду, начиная с анионов от 25 % экв. в возрастающем
порядке, затем катионы в таком же порядке.
Пример: (по
формуле)
Вода гидрокарбонатно-хлоридно-кальциево-натривая
Вывод:
вода пригодна для питья.
Вода не пригодна для питья:
1. с pH > 8,5 и < 6,5;
2. с ж > 7 мг·экв /л;
3. с М >1;
4. если хлоридов > 350 мг/л;
5. если сульфатов > 500 мг/л;
6. если Σ Cl + SO4 ≥ 450 мг/л.
Если вода не пригодна для питья, то в выводе перечислить, по каким
показателям.
Химические
анализы природных вод, мг/л
(в каждом варианте 3 задачи)
