 |
ФИЗИКА
|
| |
|||||
|
| |||||
 |
ФИЗИКА
|
| |
|||||
|
| |||||
ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ
И ТЕРМОДИНАМИКИ22. Молекулярная физика
22.2. Молекулярно-кинетическая теория идеального газа
22.2.1. Идеальный газ
Идеальный газ - это физическая модель (1.3) в которой:
а) пренебрегают собственными размерами молекул;
б) пренебрегают силами взаимодействия между молекулами, за исключением процесса их столкновений;
в) в процессе столкновения между собой и со стенками сосуда молекулы ведут себя как абсолютно упругие тела.
22.2.2. Давление
Давлением p, в случае равномерного распределения сил вдоль поверхности, называется величина
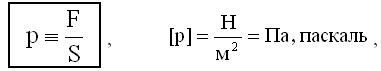
где F - сумма приложенных перпендикулярно к поверхности сил;
S - площадь поверхности.
Прибор для измерения давления называется манометром.
22.2.3. Абсолютная температура
За единицу абсолютной (термодинамической) температуры T в системе СИ принят кельвин (К). Температура в градусах Цельсия (t, ╟C) связана с T (в К) следующим равенством:
T = t + 273,15K ,причем 1╟С = 1К.
Прибор для измерения температуры называется термометром.
22.2.4. Уравнение состояния идеального газа - уравнение Клапейрона-Менделеева
Состояние некоторой массы идеального газа определяется тремя параметрами состояния:
p - давлением;
V - объемом;
T - абсолютной (или термодинамической) температурой.
Связь между этими параметрами называется уравнением состояния.
Для идеального газа уравнение состояния, установленное опытным путем, имеет следующий вид:
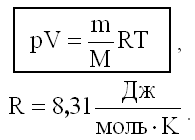
Это уравнение называется уравнением Клапейрона-Менделеева, в нем:
р - давление газа;
V - его объем;
Т - абсолютная температура;
m - масса газа;
M - молярная масса данного газа;
R - универсальная газовая постоянная.
Уравнение Клапейрона-Менделеева является обощением опытных газовых законов: Боэля-Мариотта, Гей-Люссака, Шарля. Кроме содержания этих газовых законов в уравнении Клапейрона-Менделеева содержится информация о массе газа - m и о его сорте - M.
Проверить на опыте уравнение Клапейрона-Менделеева можно с помощью экспериментальной установки, идеализированная схема которой изображена на приведенном выше рисунке. Газ в этой установке помещен в цилиндр под подвижным поршнем. Температуру газа T измеряют термометром, объем V = Sh. Давление можно найти, поделив силу F', с которой поршень давит на газ, на его площадь S. Поршень находится в равновесии и сила F' уравновешена силой давления газа F = pS.
Опыт показывает, что при значениях T и p, близких к нормальным условиям (T0 = 273,15К, p0 = 101325Па ≡ 1 атмосфера), многие газы можно считать идеальными.
22.2.5. Связь давления идеального газа с концентрацией молекул и температурой - еще одна форма уравнения состояния идеального газа
Выразим из уравнения Клапейрона-Менделеева давление
Величина
- дает число молей газа.
В самом деле, m - масса всего газа, а M - масса одного моля.
Домножим и поделим правую часть выражения для р на число Авогадро :
здесь N = νNA - число молекул газа;
- постоянная Больцмана.
с учетом этого получим связь давления идеального газа с его концентрацией и температурой
Это еще одна форма опытного уравнения состояния идеального газа.
22.2.5.1. Закон Дальтона
Если имеется смесь нескольких газов разных сортов, то n = n1 + n2 + ...
Тогда
см (22.2.5),
здесь
- парциальное давление,
т.е. давление газа i-го сорта, которое было бы в сосуде при наличии только молекул этого сорта.
Мы получили закон Дальтона, который утверждает, что давление смеси идеальных газов равно сумме парциальных давлений.
22.2.6. Основное уравнение молекулярно-кинетической теории идеального газа
Пусть газ находится в сосуде слева от стенки, на которой мы выделим площадку S. Направим ось x вправо, перпендикулярно стенке сосуда.
Пусть молекула массой m0 летит вдоль оси x со скоростью
по направлению к стенке (рис. а). После упругого удара о стенку скорость молекулы изменит свое направление на противоположное
(рис. б). Причем, модули этих скоростей равны: v1 = v2 = v.
По второму закону Ньютона (4.6) средняя сила <F'x>, действующая со стороны стенки на одну молекулу равна:
здесь v - модуль средней скорости молекул.
По третьему закону Ньютона (4.7) со стороны молекулы на стенку действует в течение промежутка времени Δt средняя сила:
Давление p (22.2.2) найдем, если среднюю силу <Fx> помножим на
Nx - число ударов молекул о стенку за время Δt, а затем поделим на S:За время Δt до стенки долетят лишь те молекулы, которые находятся от стенки не дальше, чем на расстоянии vΔt и имеют положительную проекцию скорости vx (летят к стенке).
В силу хаотичности движения молекул можно принять, что в положительном направлении оси x, к стенке, движется 1/6 часть всех молекул, 1/6 движется против оси x, аналогично - по осям y и z. Выразим число молекул в объеме SvΔt(см. рис.) через их концентрацию n (22.2.5):
Предыдущие рассуждения велись так, как будто бы скорости всех молекул одинаковы. Чтобы учесть различие скоростей молекул надо вместо v2 взять <v2> - среднее значение этой величины. Тогда для давления получим:
Полученное выражение и есть основное уравнение молекулярно-кинетической теории идеального газа:
здесь
- средняя кинетическая энергия поступательного движения одной молекулы.
| Назад |
|
Сибирская
государственная геодезическая академия (СГГА), 2006.
|
|