 |
ФИЗИКА
|
| |
|||||
|
| |||||
 |
ФИЗИКА
|
| |
|||||
|
| |||||
ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ
И ТЕРМОДИНАМИКИ
23.4.3. Поведение графика распределения Максвелла при изменении температуры и массы
Как видно из изложенного выше, см. (23.4.2.4), (23.4.2.5), (23.4.2.6),
В самом деле:
Из (23.4) и (23.4.2.4) получим:
Отсюда видно, что при увеличении температуры максимум функции F(v) смещается вправо (vвер~
) и становится ниже ( F(vвер)~1/
).
При увеличении массы молекул максимум функции F(v) смещается влево (т.к. vвер~
) и становится выше (т.к. F(vвер)~1/
).
Напомним, что площадь, ограниченная функцией F(v), остается постоянной и равной единице.
23.4.4. Пространство скоростей
Возьмем декартову систему координат, по осям которой будем откладывать значения компонент скоростей молекул идеального газа vx, vy, vz, находящегося в равновесном состоянии при температуре T. Скорости каждой молекулы будет соответствовать точка в этом пространстве скоростей. Состояние идеального газа, содержащего N молекул будет изображаться N точками в пространстве скоростей.
При столкновениях молекул положение точек в этом пространстве скоростей будет непрерывно меняться, но в равновесном состоянии плотность точек будет зависеть только от модуля скорости v и числа молекул N. Выделим в пространстве скоростей сферический слой радиусом v и толщиной dv (см. рисунок). Обозначим "объем" этого сферического слоя через . Как известно из геометрии:
здесь 4πv2 - площадь поверхности сферы радиуса v;
dv - толщина слоя на этой сфере.
Найденное в (23.4.2.1) число молекул dNv со скоростями в интервале от v до v+dv равно числу точек в пространстве скоростей, попадающих в "объем" d3v.
23.4.5. Плотность вероятности, отнесенная к "объему" в пространстве скоростей
Перепишем предыдущую формулу в следующем виде:
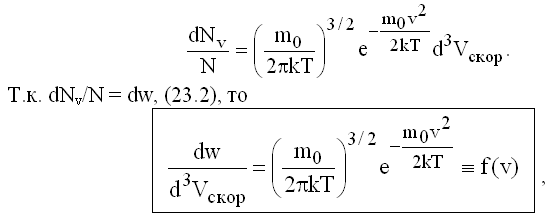
здесь f(v) - плотность вероятности, отнесенная к "объему" в пространстве скоростей.
Если учесть, что
- кинетическая энергия одной молекулы и обозначить A = (m0/2πkT)3/2, то
Эта функция и позволяет найти плотность точек в пространстве скоростей. В самом деле, т.к. dw = dNv/N, то
дает число точек в единице "объема" пространства скоростей.
23.4.6. Функция распределения по компонентам скоростей
Выделим в пространстве скоростей элемент объема в форме кубика dV'скор=dvxdvydvz, расположенного в точке, изображающей молекулу с заданным вектором скорости
.
Число молекул, имеющих скорость в пределах
равно числу точек в пространстве скоростей, попадающих в выделенный нами элемент "объема"
по (23.4.5) оно равно Nf(v) и число точек
попадающих в элемент "объема" dvxdvydvz, будет равно:
Вероятность того, что молекула имеет вектор скорости, конец которого лежит в пределах "объема" d3Vскор=dvxdvydvz, по (23.2):
Подставим сюда f(v) из (23.4.5), учтем, что v2 = vx2 + vy2 + vz2, тогда:
Здесь мы разбили на три сомножителя выражение (m0/2πkT)3/2 и экспоненту. Введем обозначения:
Функции φ(vx), φ(vy), φ(vz) - это плотности вероятностей распределения молекул по компонентам скоростей. Они имеют совершенно одинаковый вид, каждая из них нормирована на единицу, например:
Функции φ четные, график их симметричен относительно начала координат.
23.4.7. Распределение Больцмана
Пусть идеальный газ, имеющий определенную температуру T, находится во внешнем поле. Будем считать, что потенциальная энергия одной молекулы
- известная функция координат.
Концентрация молекул
в заданном месте пространства определяется распределением Больцмана:
здесь n0 - концентрация молекул в том месте, где εр = 0.
Между распределением Больцмана и распределением Максвелла есть глубокое сходство.
Вероятность
того, что молекула имеет вектор скорости
, конец которого лежит в "объеме" dvxdvydvz, равна:
см. (23.4.6), (23.4.5).
Найдем
- вероятность того, что молекула имеет координаты в пределах объема dxdydz, положение которого в пространстве задает радиус-вектор
.
Концентрация n по определению:
где dN - число частиц в объеме dV.
С учетом этого, формула распределения Больцмана примет следующий вид:
Поделим правую и левую части на N - полное число частиц, с учетом (23.2) получим:
Обозначим n0/N = B, тогда получим:
Это выражение для
имеет ту же математическую структуру, что и записанное выше выражение для
: некая постоянная умножается на экспоненту, в отрицательном показателе которой стоит отношение энергии отдельно взятой молекулы ε0 к величине kT, определяющей среднюю энергию теплового движения молекул. Только в случае распределения Максвелла в экспоненте стоит кинетическая энергия одной молекулы εк, а у распределения Больцмана - потенциальная энергия одной молекулы - εp. И там, и там - элемент объема: в распределении Максвелла - это "объем" в пространстве скоростей dvxdvydvz, в распределении Больцмана - объем в реальном пространстве dxdydz. Постоянные A и B определяются условием нормировки - полная вероятность w=1.
Лабораторная работа №6-к.
Распределение Больцмана.
23.4.8. Распределение Максвелла-Больцмана
Перемножив
и dwz, получим
- вероятность того, что молекула имеет определенный вектор скорости
и находится в определенном месте пространства
(с точностью до dvxdvydvz и dxdydz)
это и есть распределение Максвелла-Больцмана.
23.4.9. Фактор Больцмана
Сумма кинетической энергии молекулы εк и ее потенциальной энергии εr есть полная энергия молекулы ε, т.е. ε = εк+εr.
Записав показатель экспоненты в распределении Максвелла-Больцмана через полную энергию молекулы ε получим фактор Больцмана:
имеющий важное значение в статистической физике. Величине фактора Больцмана пропорциональна вероятность обнаружить систему в состоянии с энергией ε.
здесь εi - изменяющаяся дискретно, скачками энергия макроскопической системы, находящейся в состоянии с номером i.
23.4.10. Барометрическая формула
Применим распределение Больцмана для идеального газа, находящегося в однородном поле тяжести. В этом случае потенциальная энергия одной молекулы:
см. (5.7.1),
здесь g - ускорение силы тяжести,
h - высота над тем уровнем, где εр = 0.
Из (23.4.7) для концентрации молекул n будем иметь
Из (22.2.5) давление газа: p=nkT пропорционально концентрации n.
Следовательно, для зависимости давления p от высоты h имеем:
Это и есть барометрическая формула, в ней p0 - давление в том месте, где h = 0.
Если домножить и поделить показатель степени в экспоненте на число Авогадро NA, то получим барометрическую формулу в несколько ином виде:
здесь M = m0NA - масса одного моля газа,
R = kNA - универсальная газовая постоянная.
Лабораторная работа №71-к.
Распределение Максвелла.
| Назад |
|
Сибирская
государственная геодезическая академия (СГГА), 2006.
|
|