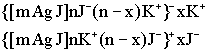Оптические свойства золей
Золи отличаются от истинных растворов визуально, с помощью так называемого
конуса Тиндаля.
Если на плоскопараллельную кювету,
заполненную истинным раствором, направить узкий луч видимого света,
то будут видны точки входа и выхода луча. Ход луча в растворе не
будет виден, рис.8.
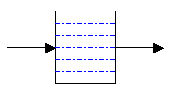
Рис.8 |
В силу того,что
частицы растворённого вещества несоизмеримо меньше длины волны
луча, луч проходит через раствор,"не замечая" эти
частицы, поэтому его ход и не виден. |
Если такой луч направить на кювету
с золем, рис.9, то ход луча будет виден в виде светящегося конуса
голубоватого цвета.
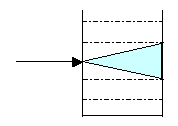
Рис.9 |
Размер частиц
дисперсной фазы меньше длины волны луча по меньшей мере в
10 раз.
Но в данном случае луч "замечает"
эти частицы и огибает их.
Происходит явление дифракции,
в результате чего и возникает этот конус. |
Электрические
свойства золей
Рассмотрим мицеллу золя в разрезе,
рис.10.
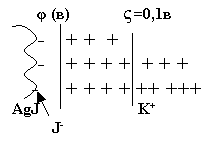
Рис.10 |
На границе определяющих
ионов и противоионов возникает потенциал φ, равный
≈ 1В.
На границе гранулы и диффузионного
слоя возникает ещё один потенциал ζ, так называемый дзета
- потенциал, величина которого не превышает 0,1В.
|
Если к раствору гидрофобного золя подвести постоянное напряжение,
то мицелла разорвётся по ζ - потенциалу. Гранула мицеллы пойдёт
к одному электроду, в соответствии со своим зарядом, а диффузионный
силой, увлекая за собой прилежащие к нему слои воды, - к другому
электроду.
Перемещение гранулы к электроду
называется электрофорезом.
Перемещение диффузионного слоя
с прилежащими слоями воды называется электроосмосом.
Поскольку диффузный слой содержит мало вещества, то его отложение
на электроде было обнаружено недавно, когда появились точные методы.
Тем не менее ζ - потенциал очень важен для существования гидрофобных
золей.
Разрушение
гидрофобных золей
{[m Ag J] n J- (n-x)K+}-x K+
Разрушение гидрофобных золей достигается добавлением к раствору
постороннего электролита. Разрушающими являются ионы электролита,
имеющие одинаковый заряд с зарядом диффузионного слоя. Разрушающая
сила ионов зависит от их заряда.
Na+ Cu2+ Al3+
Cl- SO42- PO43+
1 : 10 : 100 ---- разрушающая сила ионов возрастает на порядок.
Разрушающее действие постороннего электролита заключается в том,
что однозарядный ион вытесняет противоионы диффузионного слоя в
адсорбционный слой.
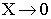 – уменьшается
заряд диффузного слоя.
– уменьшается
заряд диффузного слоя.
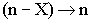 - уменьшается
заряд гранулы.
- уменьшается
заряд гранулы.
В конечном счёте уменьшается ζ - потенциал. С уменьшением ζ
- потенциала мицеллы начинают терять свою защиту и слипаются. Когда
слипание частиц достигает такого предела, что становится заметным
помутнение раствора, соответствующая этому состоянию величина ζ
- потенциала носит название – порог
коагуляции.
Состояние, при котором ζ - потенциал становится равным нулю,
называется изоэлектрическим состоянием.
При изоэлектрическом состоянии
коагуляция идёт полным ходом. Защита потеряна, и золь разрушается.
Если слить растворы, содержащие мицеллы с противоположными зарядами,
то разрушение золей пойдёт очень интенсивно, в силу взаимного притяжения
мицелл , у которых диффузионные слои имеют противоположные заряды.