Законы Фарадея
Законы Фарадея
являются количественными законами электролиза.
Первый
закон Фарадея:
Масса вещества,
выделяющегося на электродах, прямо пропорциональна количеству прошедшего
через раствор электричества
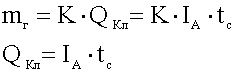 .
.
Второй
закон Фарадея:
При прохождении
через расплав или раствор электролита 96500 Кл электричества на
электродах выделяется 1 моль эквивалента вещества.
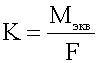 - электрохимический эквивалент вещества.
- электрохимический эквивалент вещества.
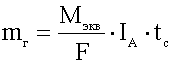 - объединённый
закон Фарадея.
- объединённый
закон Фарадея.
Поляризация
при электролизе
Поляризация при
электролизе складывается из собственно поляризации, которая делится
на химическую и концентрационную, и перенапряжения.
Химическая
поляризация
Химическая
поляризация
возникает при использовании инертных электродов.
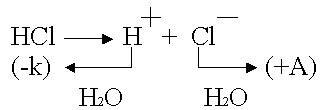 .
.
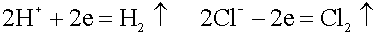 .
.
Какими бы ни были инертные электроды (Pt, С, керамика), все они
прекрасно адсорбируют газы.
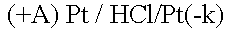 .
.
Платина – анод насыщается хлором; платина – катод поглощает водород.
Хлор может только
восстанавливаться, водород - окисляться:
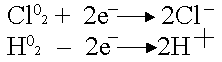 .
.
В электролизере образуется гальванический элемент:
 .
.
Электродвижущая сила возникшего гальванического элемента направлена
против внешнего напряжения и ослабляет его.
Данный вид поляризации называется химическим по той причине, что
электроды как бы меняют свою химическую природу.
Поляризация играет отрицательную роль, так как она приводит к перерасходу
электроэнергии.
С химической поляризацией борются химическим путем. В раствор добавляют
вещества, которые очищают электроды от поглощённых газов.
Концентрационная
поляризация
Данная поляризация
происходит при активном аноде, например, серебряном
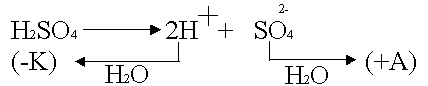
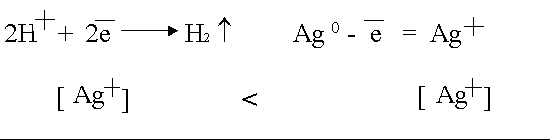 .
.
В силу диффузии
ионы серебра от анода стремятся к катоду, где они начнут восстанавливаться
как более сильные окислители.
Поскольку диффузия в жидкостях медленная, концентрация ионов Ag
в анодном пространстве намного выше, чем в катодном.
Вследствие этого в электролизере возникает концентрационный гальванический
элемент.
ЭДС возникшего концентрационного
элемента также направлена против внешнего напряжения и ослабляет
его.
С концентрационной поляризацией бороться гораздо проще, чем с химической.
Ее устраняют перемешиванием раствора.
Перенапряжение
электрода
Перенапряжением
электрода называют разность между фактическим и теоретическим электродными
потенциалами.
Перенапряжение металлов настолько мало, что им пренебрегают. Велико
перенапряжение водорода и кислорода.
Перенапряжение водорода велико при следующих условиях:
- малых плотностях
тока,
- низких температурах
раствора.
Перенапряжение
также зависит от материала катода.
Перенапряжение водорода наиболее велико на тех металлах, которые
в ряду напряжений располагаются вблизи водорода.
Перенапряжение водорода может играть как отрицательную, так и положительную
роль.
Отрицательную роль
оно играет при необходимости получить водород электролитическим
путем.
Положительна роль
перенапряжения при необходимости получить с помощью электролиза
какой - либо металл, находящийся в ряду напряжений до водорода.
Можно создать условия (плотность тока, температура раствора, материал
катода, посторонние ионы в растворе), при которых вследствие высокого
перенапряжения водорода из раствора можно восстановить металлы,
стоящие в ряду напряжения до водорода, (вплоть до алюминия).