1. Электролиз
расплава
Электроды в данном случае выполнены из пассивных материалов (платина,
графит)
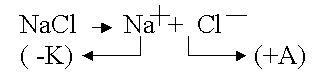 .
.
На катоде всегда происходит восстановление, на аноде – окисление
 .
.
2. Электролиз водного раствора
электролита с пассивными электродами
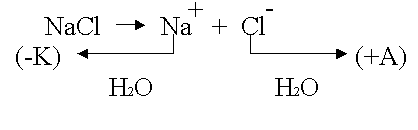 .
.
К катоду подходят
ионы натрия и молекулы воды.
Чтобы выбрать, какое вещество
будет восстанавливаться на катоде в первую очередь, надо сравнить
потенциалы данных веществ
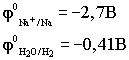 .
.
По соотношению потенциалов этих
двух веществ вода является более сильным окислителем и восстанавливается
в первую очередь.
Катодное восстановление воды:
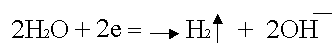 .
.
Чтобы выбрать, какое из веществ будет преимущественно окисляться
на аноде, надо также сравнить их потенциалы
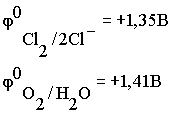 .
.
По соотношению потенциалов видно, что ионы хлора являются более
сильными восстановителями и, следовательно, будут окисляться в
первую очередь.
Анодное окисление хлора:
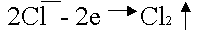 .
.
Рассотрим ещё один пример электролиза
раствора электролита с пассивными электродами:
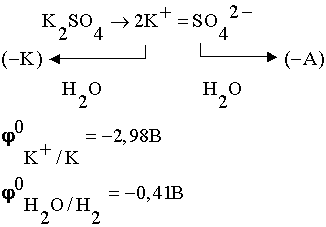 .
.
При таком соотношении потенциалов
в первую очередь будет восстанавливаться вода:
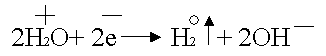 .
.
По соотношению потенциалов на
аноде в первую очередь будет окисляться вода.
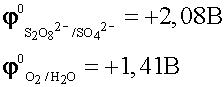 .
.
Анодное окисление воды:
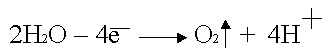 .
.
3. Электролиз раствора с активным
анодом
Cu – активный анод, в качестве
электролита – водный раствор H2SO4
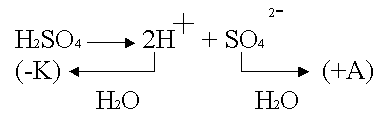 .
.
По соотношению потенциалов в первую
очередь будут восстанавливаться ионы водорода из кислоты
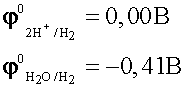 .
.
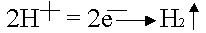 .
.
На аноде могут окисляться три вещества:
анионы электролита, молекулы воды и сам активный анод.
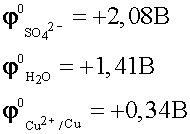 .
.
По соотношению потенциалов активный анод будет окисляться в первую
очередь:
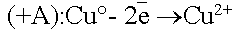 .
.
В силу диффузии ионы меди из анодого пространства, где их концентрация
высока, будут перемещаться к катоду.
Когда 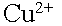 достигнет
катода, то по соотношению потенциалов меди и водорода, начнется
восстановление ионов меди:
достигнет
катода, то по соотношению потенциалов меди и водорода, начнется
восстановление ионов меди:
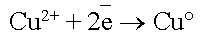 .
.