Донорно
– акцепторный механизм
ковалентной связи
| NH4+ |
H3O+ |
| ион аммония |
ион гидроксония |
| NH3 + H+ = NH4+ |
H2O + H+=
H3O+ |
Ион водорода – атом Н, потерявший свой единственный электрон
и имеющий свободную орбиталь.
H0 – e  H+
H+ |
 |
На связь с водородом идет 3 электрона атома азота

Неподелённая электронная пара
азота самопроизвольно, с энергетическим выигрышем, занимает
свободную орбиталь иона водорода.
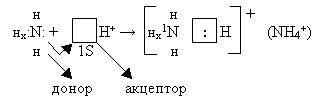 .
.
Атом азота, имеющий неподелённую
электронную пару, называется донором.
Частица принимающая электронную
пару на свою свободную орбиталь, называется акцептором.
Отсюда - донорно – акцепторная
связь.
В случае донорно – акцепторной
связи две частицы соединяются в одну при помощи электронной
пары (также как в ковалентной связи по методу валентных связей).
При возникновении донорно-акцепторной связи частицы не имеют
неспаренных валентных электронов. В данном случае одна частица
имеет неподелённую электронную пару, а другая - свободную орбиталь.
Это отличает донорно- акцепторный механизм от ковалентной связи
по методу валентных связей.
Понятие ковалентной связи объяснило образование, строение и
свойства очень многих веществ, органических и неорганических.
Но ковалентная связь не смогла
объяснить образование сложных частиц, имеющих нечётное колличество
валентных электронов; существование таких частиц, как молекулярные
ионы. А также ковалентная связь по методу ВС не объяснила парамагнитные
и диамагнитные свойства веществ.
Для ответа на все эти вопросы
в середине двадцатого века был разработан метод
молекулярных орбиталей, трактующий механизм
ковалентной связи.
По методу молекулярных орбиталей любая молекула рассматривается
как совокупность всех ядер и электронов всех атомов, образующих
данную сложную частицу.
Существует несколько вариантов этого метода. Рассмотрим один
из них, наиболее распространённый.
ЛКАО МО
– линейная комбинация атомных
орбиталей - есть молекулярная орбиталь.
Образование её можно представить
как результат сложения и вычитания комбинируемых атомных орбиталей.
Если атомные орбитали обозначить φA и φB,
то их линейная комбинация даст молекулярные орбитали двух типов.
При сложении возникает молекулярная орбиталь ψ+,
при вычитании - ψ-.
Сложение означает, что молекулярная
орбиталь характеризуется повышенной электронной плотностью в
пространстве между ядрами, поэтому энегетически она выгоднее
исходных атомных орбиталей. Такая орбиталь называется связующей.
При вычитании атомных орбиталей
образуется орбиталь с пространственным разрывом между ядрами.
Электронная плотность равна нулю, и подобная орбиталь энергетически
менее выгодна, чем исходные атомные орбитали. Такая молекулярная
орбиталь называется разрыхляющей.
Молекулярные орбитали дополняются
электронами по тем же законам,что и атомные - согласно принципу
наименьшей энергии и запрету Паули.
Молекулярные орбитали располагаются
по уровню энергии в следующем порядке:
σсв
1S < σразр 1S < σсв
2S < σразр 2S < σсв
2Px < πсв 2Py= πсв
2PZ < πсв 2Py = πсв
2PZ < σсв 2Px
Ион водорода H2+
имеет один электрон, который займёт наиболее энергетически выгодную
орбиталь σсв 1S.
Электронная формула данного
иона:
σсв
1S1.
Молекула водорода H2
имеет два электрона и его электронная формула:
σсв
1S2.
Существует критерий, по которому определяют, образовалась ли
прочная частица.
Этот критерий называют порядком
связи.
Порядок связи (N) оценивается
полуразностью связующих и разрыхляющих электронов
 .
.
Чем выше порядок
связи, тем прочнее ковалентная частица. Если порядок связи равен
нулю, частица не существует.