Внутренняя энергия
– U. Измеряется и рассчитывается не сама энергия, а её изменение
ΔU=
U2-U1 кДж/моль.
Согласно первому началу термодинамики, количество энергии, которое
поглощается или выделяется в форме теплоты Q
и работы A, постоянно
для данного процесса, т.к. энергия не может исчезать или возникать,
и следовательно, количество подведённой теплоты и
совершённой работы равно изменению внутренней энергии:
Q + A = ΔU.
Работа, как правило, совершается против внешних сил
A = -P (V2-
V1)= -PΔV.
Подвод теплоты к системе может осуществляться при двух процессах:
Изохорный процесс:
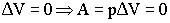
Вывод: при изохорном процессе подведённая теплота полностью расходуется
на изменение внутренней энергии системы
QV
= ΔU.
Изобарный процесс:
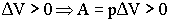
ΔU= Qp
+ A = Q- pΔ V ;
Qp=
ΔU – A = ΔU + pΔ V
Qp=
U2-U1 +
p(V2 – V1)
= ( U2 + pV2 )
– (U1 + pV1).
Функция U + pV = H – называется энтальпией.
Итак, U2
+ pV2 и U1
+ pV1 – величины энтальпий для состояний
2 и 1 системы, соответственно:
U2
+ pV2 = H2;
U1
+ pV1 = H1.
Тогда Qp
= H2 – H1
= ΔH.
Теплота, подведённая к системе при постоянном давлении, равняется
изменению энтальпии данной системы.
Изменение энтальпии
– теплота, выделевшаяся при изобарном процессе.
Поскольку энтальпия выводится из внутренней энергии, она также является
функцией состояния. Измеряется и рассчитывается не сама энтальпия,
а её изменение, приведённое к нормальным условиям:
H2
– H1 = ΔH 0298
кДж/моль.
Образование веществ может происходить как с поглощением, так и с
выделением энергии.
Если величина Qp
положительна, то реакция эндотермическая, т.е. энтальпия продуктов
реакции выше энтальпии исходных веществ.
Если величина Qp
отрицательна, то реакция экзотермическая: энтальпия продуктов реакции
ниже энтальпии исходных веществ.
Энтальпия простых веществ принимается равной нулю (ΔH 0Cu;
ΔH 0 O3).
Вещество тем прочнее,
чем больше энергии выделяется при его образовании. Изменение энтальпии
химической реакции, то - есть и тепловой эффект, подчиняется закону
Гесса (1840г).
Закон Гесса.
Тепловой эффект
химической реакции зависит только от начального и конечного состояния
химической реакции, то - есть зависит от вида и состояния исходных
веществ и продуктов реакции.
Следствие закона Гесса:
Изменение энтальпии
химической реакции равно сумме изменений энтальпий продуктов реакции
за вычетом суммы изменения энтальпий исходных веществ.
aA + bB = cC + dD
ΔH 0х.р.
= (cΔH 0C
+ dΔH 0D
) – (aΔH 0A
+ bΔH 0B
) кДж.