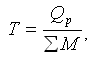Теоретические основы производства металлов
|
В природе все металлы (кроме золота, серебра и платиновых) находятся в различных, главным образом оксидных соединениях (рудах). Поэтому основная задача при получении металлов состоит в восстановлении их из оксидов. Восстановлением называется процесс превращения оксидов в элементы или перевод высших оксидов в низшие путём отнятия от них кислорода при помощи восстановителей: C, CO, H2 и других веществ, обладающих большим сродством к кислороду, чем восстанавливаемые элементы. С точки зрения электронной теории, окисление состоит в потере электронов окисляющимся веществом. Наоборот, при восстановлении оно получает обратно отданные ранее электроны. Следовательно, сущность восстановления состоит в присоединении электронов восстанавливающимся веществом. Таким образом, окислительно-восстановительные реакции определяют процессы, связанные с переходом электронов от одних атомов к другим. Типичный процесс восстановления оксидов можно представить следующей реакцией: MeO + B = Me + BO, где МеО – оксид любого металла; В – восстановитель; ВО – оксидная форма восстановителя. При этом исходный оксид является окислителем по отношению к восстановителю и приобретает электроны, в то время как восстановитель их отдает. Возможно также восстановление путем электролиза водных и солевых растворов. В этом случае надо рассматривать условия присоединения электронов к катиону металла. Условием прямого протекания реакции восстановления (слева направо) является отрицательное значение изобарного потенциала: ?Z < 0, т. е. самопроизвольный процесс восстановления возможен при условии убыли свободной энергии системы. Чем более отрицательное значение ?Z, тем более устойчив образующийся оксид и тем труднее он восстанавливается. Не менее важным показателем сродства восстанавливаемого металла к кислороду является упругость диссоциации оксида металла PO (МеO) и оксида восстановителя PO (BO). Оксид, имеющий меньшую упругость диссоциации, более прочен, а образующее его вещество обладает большим сродством к кислороду и поэтому способно отнять кислород от оксида восстанавливаемого металла. Таким образом, восстановителем может быть любой элемент, упругость диссоциации оксида которого меньше упругости диссоциации восстанавливаемого оксида. Если металлы расположить в ряд по возрастанию упругости диссоциации их оксидов, то можно утверждать, что в этом ряду каждый предыдущий металл может служить восстановителем для оксида последующего металла. Об этом же можно судить по графику изменения термодинамического потенциала ?Z (рис. 35) различных оксидов в зависимости от температуры. Чем более отрицателен изобарный потенциал, тем интенсивнее образуется оксид.
Очевидно, что медь и никель будут восстанавливаться из их оксидов легче, чем железо. Поэтому в условиях доменной печи или вагранки Cu и Ni полностью переходят в жидкий чугун. Оксиды железа в этих условиях также почти полностью восстанавливаются. Хром же из оксида Cr2O3 восстанавливается труднее железа, так как ?ZCr O имеет более отрицательное значение, чем ?ZFeO. Еще хуже восстанавливается марганец из MnO, не говоря уже о кремнии и титане, которые как в доменном процессе, так и при плавке в вагранке, почти не восстанавливаясь, переходят в шлак. Что касается алюминия, магния, кальция, то их оксиды, не восстанавливаясь, переходят в шлак, разжижая его. Располагая оксиды по возрастающей величине сродства металла к кислороду, получим ряд: Cu2O; NiO; MoO3; FeO; P2O5; ZnO; MnO; SiO2; Al2O3; MgO; CaO, из которого видно, что железо может быть восстановителем для меди, а для железа восстановителями могут быть цинк, марганец, фосфор, магний, кремний, алюминий, кальций. Чем дальше в этом ряду стоят друг от друга оксиды, тем энергичнее будет реакция восстановления. Недостатком углеродотермического восстановления, чаще всего применяющегося на практике, являются эндотермичность процесса (реакции протекают с большим поглощением тепла). При использовании в качестве восстановителя металла, имеющего более высокое химическое сродство к кислороду, чем металл восстанавливаемого оксида, процесс идёт с выделением тепла и возможно получение как чистых металлов, так и сплавов или соединений (металлидов). Впервые металлотермический процесс был осуществлен Н.Н. Бекетовым в 1865 г. Процессы алюминотермии могут быть применены не только для получения железа, но и марганца, титана, а также сплавов: ферротитана, феррованадия и др. Рассмотрим общие основы теории металлотермических процессов. Реакция металлотермического восстановления металлов: МеХ + Ме' - Ме'Х + Ме, где Ме – металл; Ме' – металл-восстановитель; Х – может быть кислород, хлор, фтор, протекает слева направо при условии: ?Z = ?ZМе'Х – ?ZМеХ < 0, где ?ZМе'Х и ?ZМеХ – изобарные потенциалы реакций образования МеХ и Ме'Х из элементов. Приближённые значения ?Z можно найти на диаграмме рис. 35. Как указывалось выше, для полноты протекания реакции восстановления слева направо величина ?Z реакции должна быть достаточно большой, т. е. сродство Ме' к элементу Х (?ZМе'Х) должно быть значительно больше сродства Ме к элементу Х. Если стандартная величина сродства Ме к Х (?ZМеХ) больше, чем у Ме' к величине Х (?ZМе'Х), то реакция между МеХ и Ме' всё же может произойти при условии, что растворяются Ме в Ме' или Ме' в МеХ, либо когда Ме или Ме'Х – парообразные вещества. Однако реакция пройдет не полностью. Чем меньше абсолютное значение ?Z, тем глубже пройдёт реакция восстановления. Хотя изобарный потенциал ряда реакций обусловливает их протекание и при относительно низких температурах, тем не менее вследствие рассеивания тепла скорость этих реакций чрезвычайно мала. Для обеспечения заметного повышения температуры всей реагирующей системы за счёт выделяющегося тепла применяют так называемые «подогревающие добавки» или инициирующие смеси. Так, например, авторы успешно использовали инициирующую смесь (КClO3 + 3Mg) в процессах магниетермического восстановления В2О3 по реакции: В2О3 + 3Mg = 2B + 3MgO. С увеличением содержания инициирующей смеси термичность шихты увеличивается. Оптимальным было соотношение по массе:
Термичность, или величина удельного теплового эффекта металлотермического про-цесса, рассчитывается путем деления общего теплового эффекта реакций на сумму моле-кулярных масс реагирующих веществ:
где Т – термичность шихты, ккал(кДж)/кг; Qp – тепловой эффект металлотермической реакции, ккал (кДж); ?M – сумма молекулярных весов реагирующих веществ, кг. Все металлотермические реакции в зависимости от тепловых эффектов могут быть подразделены на четыре группы: вяло-термичные, идущие, как правило, без образования раздельных границ металла и шлака; спокойно-термичные; бурно-термичные, протекающие быстро и при высокой температуре; взрывного типа, сопровождающиеся зачастую выбросом шихты. Авторами была предложена следующая классификация магниетермических процессов (рис. 36).
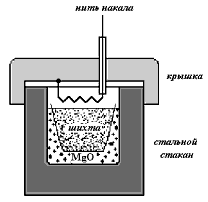
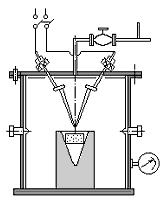
Скорость металлотермических реакций при одном и том же удельном тепловом эффекте сильно зависит от степени измельчения компонентов шихты, формы частиц, давления, среды и других факторов. На рис. 37 и 38 приведены схемы реактора и бомбы, которые использовали авторы данной работы при исследовании металлотермических процессов. Бомба объёмом около 150 см3 представляла собой стальной стакан с крышкой. Внутри стакана устанавливался корундовый тигель с шихтой. Пространство между тиглем и корпусом бомбы засыпалось оксидом магния. Внутренняя часть крышки защищалась экраном из листового молибдена (на рисунке не показан). Реакция возбуждалась нитью накала из вольфрама. Реактор второго типа представлял герметичный стальной цилиндр с крышкой, на которой крепились электрододержатели и кран. Внутри цилиндра устанавливался тигель с шихтой. Реактор был снабжен смотровыми окнами и мановакууметром. Инициирование реакции производилось с помощью электродуги, возникающей между графитовыми электродами.
|