В случае, если площадь адсорбента измерить трудно, то площадь его
поверхности заменяют его массой
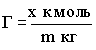 .
.
В данном случае (поглощение газа
твёрдым адсорбентом) адсорбция является функцией температуры и газового
давления.
Г= f (T, P)
Адсорбция происходит при постоянной
температуре (T = const). Величина адсорбции является функцией аргумента
Р:
Г = f (P)
Это равенство имеет графическое выражение, рис.3, которое называется
изотермой адсорбции.
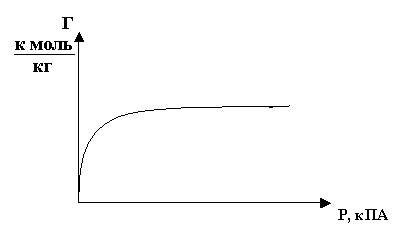
Рис.3
Участок прямой соответствует равновесному
состоянию:
V адсорбции
= V десорбции.
Существует уравнение Фрейндлиха, графическое выражение которого
позволяет этот график представить в виде прямой:
Х = кP1/n - уравнение Фрейндлиха
Х – количество адсорбата на 1 г адсорбента
к, 1/n - константы
Р – газовое давление, кПа.
Прологарифмируем это уравнение:
lg X = lg к + 1/n
lg P, рис.4
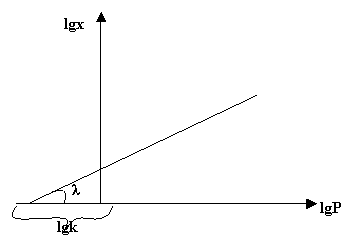 |
Тангенс угла
наклона прямой (tgλ) равняется величине 1/n.
Отрезок, отсекаемый по оси х, равен величине lgк
|
Рис. 4