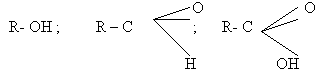
Углеводородные радикалы (CH3-; C2H5-;
C17H35- и т.д) представляют собой неполярную
часть ПАВ’а, которая может быть как угодно длинной.
Функциональные группы
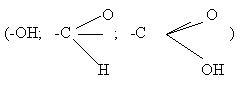
представляют полярную часть ПАВ’а.
Примеры ПАВ'ов: олеиновая кислота (С17H33COOH),
мыло (C17H35COONa).
Рассмотрим изменение поверхностного
натяжения жидкости при увеличении в ней концентрации ПАВ’а, рис.6.
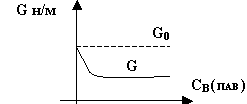
Рис.6
Молекулы ПАВ’а менее полярны, чем
молекулы воды. Благодаря этому взаимодействие молекул воды между
собой сильнее, чем молекул воды с молекулами ПАВ’а. В результате
молекулы ПАВ’а будут вытесняться из раствора в поверхностный слой.
Повышение концентрации третьего вещества в поверхностном слое, в
частности, молекул ПАВ’а, приводит к понижению поверхностного натяжения.
Адсорбция
из растворов электролитов
Адсорбция из растворов электролитов
происходит на, так называемых, адсорбентах ионного строения, которыми
служат труднорастворимые электролиты, например, Al (OH)3
Bi I3.
Адсорбенты ионного строения адсорбируют на своей поверхности или
ионы, входящие в их кристаллическую решётку, или ионы, имеющие с
ними близкое химическое строение.
AB = A+
+ B-
Электролит АВ может адсорбировать
на своей поверхности катионы A+ или анионы B-.