1. Кристаллизация металлов
|
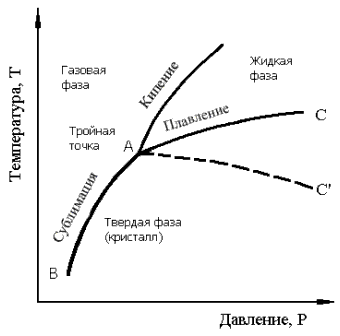
Переход металла из жидкого состояния в твёрдое кристаллическое называется кристаллизацией. Вместе с тем, в некоторых учебниках кристаллизация определяется как переход металла из жидкого состояния в твёрдое. Такое определение устарело. Оно не точно, поскольку в настоящее время многие металлические материалы, благодаря высоким скоростям охлаждения их расплавов, получают не в кристаллическом, а в аморфном состоянии. Одно из современных определений понятия «кристаллизация» звучит так: «Кристаллизация – образование кристаллов при переходе вещества из термодинамически неустойчивого состояния (жидкого, твёрдого, газообразного) в устойчивое». На рис. 10 представлена так называемая Р–Т диаграмма состояния чистого вещества.
Из показанных на данном рисунке линий – «плавление», «кипение» и « сублимация» – первые две не нуждаются в пояснении, поскольку понятия «плавление» и «кипение» хорошо известны из школьного курса. Дадим определение третьему понятию – «сублимации». Сублимация – переход вещества из твёрдой фазы Из рис. 10 следует, что вещество в кристаллическом состоянии (область ниже ВАС или ВАС') может быть получено, кроме обычных хорошо известных путей: «жидкость > твёрдое» (например, замерзание водоёмов, процессы пайки) или «газ > жидкость > твёрдое», также путем «газ > твёрдое» (осаждение из газовой фазы). Первые два процесса, как видно из диаграммы, протекают при давлениях, превышающих давление в тройной точке А, а осаждение из газовой фазы – при меньших давлениях. Данное выше определение кристаллизации предусматривает еще один путь получения кристаллического вещества, а именно «твёрдое > твёрдое». Наглядный пример «твёрдого» пути – переход вещества из аморфного состояния в кристаллическое. Проанализируем наиболее «близкий» нам и кажущийся на первый взгляд простым процесс перехода металла из жидкого состояния в твёрдое кристаллическое (так называемая первичная кристаллизация). Уместно напомнить, что согласно второму закону термодинамики ни один процесс не может самопроизвольно совершаться без уменьшения свободной энергии Гиббса. Следовательно, предпочтительность образования той или иной фазы, в данном случае твёрдой или жидкой, определяется тем, какая из фаз при заданных условиях, например, температуре, будет обладать меньшей свободной энергией. Из курса термодинамики известно, что свободной энергией (термодинамическим потенциалом) называют ту составляющую полной энергии вещества, которая обратимо изменяет свою величину при изменении температуры. G = H – TS, где G – свободная энергия; H – полная энергия системы; T – абсолютная температура; S – энтропия.
На рис. 11 показана температурная зависимость свободной энергии твёрдой и жидкой фаз. Видно, что величина свободной энергии Выше температуры Тр более устойчив жидкий металл, ниже – твёрдый. Очевидно, что процесс кристаллизации будет развиваться при некотором переохлаждении металла ниже равновесной температуры Тр, т. е. при условии, когда возникает разность свободных энергий твёрдого и жидкого металлов ?G. Разность между величиной Тр и температурой кристаллизации Тк – ?Т = Тр ? Тк получила название степени переохлаждения. Степень переохлаждения зависит от скорости охлаждения расплава.
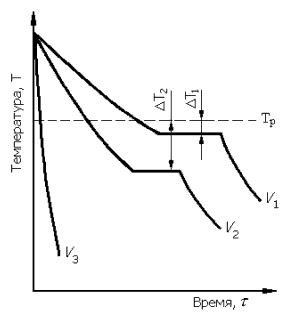
На рис. 12 приведены кривые охлаждения, характеризующие процесс кристаллизации чистых металлов с разной скоростью V : V3 >> V2 > V1. Видно, что при очень медленном охлаждении процесс кристаллизации протекает при температуре, близкой к равновесной, т. е. при небольшой степени переохлаждения. С увеличением скорости охлаждения степень переохлаждения возрастает, т. е. процесс кристаллизации протекает при более низкой температуре. Горизонтальные участки на кривых охлаждения соответствуют температуре кристаллизации и обусловлены выделением скрытой теплоты кристаллизации. По длине они отвечают продолжительности кристаллизации. При очень больших скоростях охлаждения могут быть получены металлические стёкла – аморфный металл. В этом случае горизонтальной остановки не будет (кривая V3). Степень переохлаждения зависит также от природы металла и его чистоты и составляет обычно 10–30 оС. Чистые металлы более склонны к переохлаждению. Наш выдающийся соотечественник Д.К. Чернов впервые установил, что процесс кристаллизации начинается с образования кристаллических зародышей – центров кристаллизации – и продолжается в процессе роста их числа и размера. Пока только что зародившиеся кристаллы растут свободно, они имеют достаточно правильную геометрическую форму. Зарождение центров кристаллизации может происходить двумя путями: самопроизвольно (гомогенно) или гетерогенно, т. е. на инородных твёрдых частицах, присутствующих в расплаве, в том числе на стенках сосуда. |