4. Диаграммы состояния систем, в которых компоненты
образуют химические соединения
|
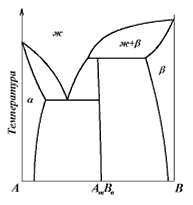
Компоненты системы могут образовывать между собою химические соединения, характеризующиеся различной прочностью. Одни из них сохраняются при переходе в жидкое состояние, другие разлагаются, не достигая точки плавления. В первом случае идёт речь о так называемом конгруэнтном плавлении, а во втором – инконгруэнтном (от лат. congruent – совпадающий, incongruent – несовпадающий). Эти наименования указывают на совпадение или несовпадение состава жидкости, образующейся при плавлении соединения, с составом соединения. Один из вариантов диаграммы состояния с устойчивым химическим соединением показан на рис. 27. Прочное химическое соединение АmBn является, по существу, самостоятельным компонентом. Поэтому эту диаграмму можно рассматривать как сложную диаграмму, составленную из двух диаграмм: диаграммы сплавов химического соединения с компонентом A
Вариант диаграммы состояния с неустойчивым химическим соединением приведён на рис. 28. Видно, что инконгруэнтное плавление состоит в разложении соединения с образованием жидкости и твёрдой фазы: АmBn-ж + ?. Образование соединения, очевидно, описывается обратным процессом ж + ?-АmBn. Этот процесс представляет не что иное, как трёхфазное перитектическое превращение жидкости совместно с ?-твёрдым раствором. Только в данном случае по перитектической реакции образуется не твёрдый раствор, как это имело место раньше (см. рис. 26), а химическое соединение строго определённого состава. Разумеется, что в результате превращения может образоваться и твёрдый раствор на основе химического соединения. Показанную на рис. 28 диаграмму состояния нельзя рассматривать как сочетание двух диаграмм. Это связано с тем, что ордината соединения проходит через двухфазную область ж + ?. Завершая анализ простейших диаграмм состояния, внимание читателя полезно обратить на те существенные закономерности, которые вытекают из правила фаз и дают в руки мощное средство контроля правильности диаграмм состояния, построенных в условиях, близких к равновесию. Эти закономерности следующие. Поскольку число степеней свободы не может быть меньше нуля или дробным числом, то в двойной системе в равновесии не может находиться больше трёх фаз. На диаграммах состояния двойных сплавов равновесию или взаимному превращению двух фаз отвечает пара кривых (или две ветви одной кривой), а равновесию или взаимодействию трёх фаз – горизонталь. Другими словами, всякая горизонталь – это место встречи трёх фаз, а всякая кривая – граница, где встречаются области двух фаз. На любой горизонтали обязательно присутствуют три точки (из них две всегда по концам горизонтали), соответствующие концентрациям трёх равновесных фаз. Из правила фаз вытекает важная закономерность о числе фаз в граничащих друг Отмеченные закономерности читатель может проследить на рассмотренных выше диаграммах состояния. Правило фаз Гиббса используется не только для контроля правильности диаграмм состояния, но и их теоретического построения [1, 13]. |