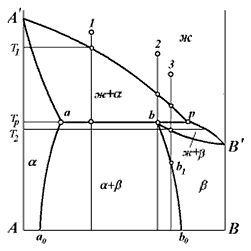
3. Диаграмма состояния перитектического типа
|
Кроме рассмотренного эвтектического равновесия между жидкостью и двумя твёрдыми фазами ж-? + ?, в двойной системе возможно другое трехфазное равновесие вида ж + ?-?, называемое перитектическим. Перитектика (от греч. – плавлю, расплавляю) – «жидкий раствор, который может находиться при данном давлении в равновесии с двумя или более твёрдыми фазами, одни из которых при отнятии от системы теплоты растворяются, другие – выделяются. Число твёрдых фаз равно числу компонентов системы, в соответствии с чем различают двойную перитектику, тройную и т. д.». «Перитектикой также нередко называют точку, в которой пересекаются линии температур начала кристаллизации двух твёрдых фаз в равновесии с жидкостью перитектического состава».
Диаграмма состояния перитектического типа приведена на рис. 26. Линия А'рВ' cooтветствует линии ликвидуса, а линия А'аbВ' – линии солидуса. Перитектическому превращению, как и эвтектическому, на диаграмме состояния отвечают три точки: а, b и р. Точку р называют перитектической, Проследим механизм перитектического превращения на примере кристаллизации трёх сплавов, ординаты которых на рис. 26 обозначены цифрами 1, 2 и 3. Кристаллизация сплава 1 начинается при температуре Т1 выделением кристаллов ?-твёрдого раствора. Этот процесс продолжается до перитектической температуры Тр. Заметим, что точка р является точкой пересечения кривых ликвидуса ? и ?-твёрдых растворов. Следовательно, жидкость оказывается насыщенной ?-кристаллами. Поэтому из жидкости начинают выделяться При кристаллизации сплава 2, как и в предыдущем случае, сначала также выделяются ?-кристаллы, а при перитектической температуре протекает трёхфазное превращение Кристаллизация сплава 3 начинается также с выделения ?-кристаллов. При перитектической температуре трёхфазное превращение ж + ?-? заканчивается их исчезновением. Из оставшейся непрореагировавшей жидкости, уже в отсутствие ?-твердого раствора, до температуры Т2 будут выделяться ?-кристаллы. При этой температуре вся жидкость затвердевает, а сплав представляет собою однородный ?-твёрдый раствор. При дальнейшем охлаждении по достижении точки b1, начнётся распад ?-твёрдого раствора с выделением Можно объяснить и по-другому, почему уже выпавшие ?-кристаллы растворяются в той самой жидкости, из которой они только что выделились. Дело заключается в том, что если до перитектической температуры в равновесии друг с другом были только жидкость Таким образом, при перитектическом превращении, в отличие от эвтектического, только часть сплавов, испытывающих трёхфазное превращение, затвердеет при перитектической температуре. Состав этих сплавов лежит в интервале концентрации между точками а и b. Другая часть сплавов, испытывающих трёхфазное превращение и расположенных в интервале концентраций между точками b и р, затвердевает ниже перитектической температуры. Перитектическими сплавами называют сплавы, кристаллизующиеся из жидкости путем выделения твёрдой фазы с последующим образованием из неё и оставшейся жидкости второй твёрдой фазы. Степень свободы при перитектическом превращении равна нулю. Поэтому перитектическая реакция, как и эвтектическая, протекает при постоянной температуре. Разумеется, что, пока из расплава выделяется только один вид кристалла, по отношению к которому насыщение достигается раньше, степень свободы будет равна единице. Поэтому процесс кристаллизации будет протекать в интервале температур. На кривых охлаждения сплавов, испытывающих перитектическое превращение, будет наблюдаться перелом, соответствующий началу кристаллизации одной твёрдой фазы, и горизонтальная площадка, соответствующая собственно перитектическому процессу. |